Ο αναπτυξιακός ρόλος του κλάδου των κλινικών μελετών στη χώρα μας μέσω της προσέλκυσης επενδύσεων αποτελεί ίσως τη μεγαλύτερη πρόκληση του τομέα της Υγείας.
Η Ελλάδα απορροφά 120 εκατ. ευρώ από τις κλινικές μελέτες όταν θα μπορούσε να φτάσει τα 500 εκατ. ευρώ ετησίως αυξάνοντας με 1,1 δισ. ευρώ το ΑΕΠ και ανοίγοντας 23.000 νέες θέσεις εργασίας.
Η διασύνδεση και αλληλεπίδραση της χώρας με το ευρωπαϊκό περιβάλλον, η ανάγκη της άμεσης προσαρμογής της Ελλάδας στο νέο, ενιαίο πλαίσιο ρύθμισης και λειτουργίας των κλινικών μελετών και κυρίως η ανάδειξη των οφελών από την εθελοντική συμμετοχή των ασθενών στις μελέτες είναι μερικά από τα σημεία καμπής που πρέπει να ξεπεραστούν, σύμφωνα με την πρόεδρο του Συλλόγου HACRO, Ευαγγελία Κοράκη
Τα οικονομικά οφέλη της Ελλάδας
Σύμφωνα με την κα Κοράκη, η χώρα μας συγκρίνεται σε όλα τα επίπεδα με τα υπόλοιπα κράτη μέλη της Ευρώπης στα κριτήρια προσέλκυσης των διαθέσιμων επενδυτικών κεφαλαίων. Πρόσφατες έρευνες που έχουν διεξαχθεί από τις εταιρείες PwC, IQVIA και το ΙΟΒΕ, δείχνουν ότι τα κυριότερα κριτήρια προσέλκυσης επενδύσεων είναι η ταχύτητα διεξαγωγής, τα ποιοτικά κριτήρια όπως η εμπειρία, η τεχνογνωσία, η συνέπεια, οι υποδομές, η σταθερότητα και τα οικονομικά κίνητρα.
Σήμερα στην Ευρώπη, όπως αναφέρει ο Ευρωπαϊκός Οργανισμός Φαρμάκων (EMA), εγκρίνονται πάνω από 4.000 κλινικές δοκιμές κάθε χρόνο, το 65% εκ των οποίων χρηματοδοτούνται από τις φαρμακευτικές εταιρείες. Το 2023, οι εταιρίες αυτές εκτιμάται ότι επένδυσαν συνολικά 50 δισ. ευρώ σε Έρευνα & Ανάπτυξη στην Ευρώπη. Διαχρονικά, η συγκριτική θέση της Ελλάδας στην Ευρώπη ως προς τον αριθμό κλινικών μελετών δεν είναι ικανοποιητική.
Όπως δείχνουν τα στοιχεία του ClinicalTrials.gov για την περίοδο 2000-2020, στην Ελλάδα διεξήχθησαν συνολικά 3.101 μελέτες, 1,7% μόνο του συνόλου των κλινικών μελετών που διεξήχθησαν στην Ευρώπη την ίδια περίοδο. Ωστόσο, ο αντιπρόεδρος της HACRO Νίκος Κωστάρας επισημαίνει, ότι την τελευταία πενταετία οι δείκτες παρουσίασαν σαφή βελτίωση, αφού όπως δείχνουν τα στοιχεία του Εθνικού Οργανισμού Φαρμάκων, από το 2019 μέχρι το 2022, οι εγκρίσεις αιτημάτων για τη διεξαγωγή νέων κλινικών μελετών είχαν σημαντική αύξηση κατά 70% (262 εγκεκριμένες για φάρμακα και ιατροτεχνολογικά το 2022 έναντι 154 το 2019). Για το 2023 μάλιστα παρατηρήθηκε ένας αριθμός ρεκόρ σε υποβολές αιτημάτων από τους χορηγούς, που έφτασαν τις 320 αιτήσεις για έγκριση νέων κλινικών μελετών, 298 με φάρμακο και 22 με ιατροτεχνολογικά προϊόντα. Και για το 2024, μέχρι τον Ιούνιο είχαν λάβει έγκριση 201 μελέτες με φάρμακο και 20 με ιατροτεχνολογικά προϊόντα.
Παρόλα αυτά η Ελλάδα απορροφά 120 εκατ. ευρώ από τις κλινικές μελέτες όταν θα μπορούσε να φτάσει τα 500 εκατ. ευρώ. Με τη σημερινή εικόνα της χώρας αν τραβούσαμε τις επενδύσεις από τις κλινικές μελέτες και φτάναμε τα 500 εκατ. ευρώ σε ετήσια βάση θα πετυχαίναμε 1,1 δισ. ευρώ αύξηση του ΑΕΠ, 270 εκατ. ευρώ έσοδα από φόρους, 23.000 νέες θέσεις εργασίας υψηλού επιπέδου όπως γιατροί, νοσοκόμοι, νοσηλευτές, λοιπό επιστημονικό προσωπικό και μείωση της ανεργίας.
Οι πρώτες νομοθετικές παρεμβάσεις από το υπουργείο Υγείας αφορούν:
- το επενδυτικό Clawback (ν. 4712/2020 & 4965/2022), το οποίο προβλέπει συμψηφισμό της αυτόματης επιστροφής με ποσοστά επί των δαπανών έρευνας και ανάπτυξης,
- τη δυνατότητα των νοσοκομείων του ΕΣΥ (ν. 4950/2022), να έχουν έσοδα από τη διεξαγωγή βιοϊατρικής έρευνας, καθ’ υπέρβαση του κρατικού προϋπολογισμού. Επιπλέον, αυτούς τους πόρους, θα μπορούν να τους διαθέσουν τα νοσοκομεία για την προμήθεια νέου ιατροτεχνολογικού εξοπλισμού ή την αναβάθμιση των υποδομών τους,
- και τη δυνατότητα σύστασης αυτοτελούς τμήματος Κλινικών Μελετών στα νοσοκομεία του ΕΣΥ (Ν. 5041/2023, ΦΕΚ 87/Α/8-4-2023).
Παρόλα αυτά, ενώ θεσμοθετήθηκε το επενδυτικό clawback το οποίο θα μπορούσε να δώσει μια σημαντική ώθηση δυστυχώς, το 2020 το σύστημα αυτό εντάχθηκε στο Ταμείο Ανάκαμψης και χάθηκαν οι προϋποθέσεις για τα έξοδα των R&D. Η λύση είναι να παραμείνουν τα κριτήρια ως είχαν για να συμπεριληφθούν και οι πολυεθνικές στο επενδυτικό clawback. Αν θέλουμε η χώρα να φέρει μεγάλα έσοδα από τις μελέτες, το υπουργείο πρέπει να βελτιώσει τις προϋποθέσεις συμψηφισμού, να υλοποιήσει το Εθνικό Μητρώο Βιοϊατρικής Έρευνας, να ενισχύσει τα οικονομικά κίνητρα για τις φαρμακευτικές εταιρίες που δραστηριοποιούνται στην Ελλάδα αλλά και γι’ αυτές που δεν έχουν παρουσία εδώ και να στελεχώσει τον ΕΟΦ και την Εθνική Επιτροπή Δεοντολογίας με επαρκές και κατάλληλα εκπαιδευμένο προσωπικό.
Γραφεία Κλινικών Μελετών
Η Ελλάδα έχει τη δυναμική, διαθέτει επιστήμονες παγκοσμίου φήμης, έχει ερευνητικά κέντρα και μπορεί να έχει και ανταγωνιστικά κόστη. «Χρειαζόμαστε οικονομικά κίνητρα, φοροαπαλλαγές κ.λπ.» επισημαίνει ο κ. Κωστάρας, προκειμένου να αποφέρουν οι κλινικές μελέτες πολλά περισσότερα έσοδα και στην Ελλάδα. Δεν μπορεί στην Ελλάδα να απασχολούνται μόλις 170 άτομα στον τομέα αυτό όταν η Βουλγαρία έχει φτάσει τους 1.200 εργαζόμενους».
Με στόχο την προαγωγή της έρευνας για την ανάπτυξη νέων φαρμάκων και τη διεύρυνση της πρόσβασης των Ελλήνων ασθενών σε καινοτόμες θεραπείες, το υπουργείο Υγείας επιταχύνει τις διαδικασίες για τη σύσταση και λειτουργία αυτοτελών τμημάτων κλινικών μελετών. Τα τμήματα θα λειτουργήσουν σε κάθε νοσοκομείο του Ε.Σ.Υ. δυναμικότητας μεγαλύτερης των 200 κλινών, ενώ για τη σύσταση, η δαπάνη εκτιμάται σε 4.524 ευρώ ετησίως ανά τμήμα ή συνολικά σε 294.000 ευρώ, εφόσον συσταθούν Τμήματα σε όλα τα νοσοκομεία του ΕΣΥ δυναμικότητας άνω των 200 κλινών τα οποία ανέρχονται σε 65.
Με Κοινή Υπουργική Απόφαση την οποία υπογράφουν ο υπουργός Εσωτερικών Θεόδωρος Λιβάνιος, ο υφυπουργός Εθνικής Οικονομίας και Οικονομικών Αθανάσιος Πετραλιάς και ο υφυπουργός Υγείας Μάριος Θεμιστοκλέους, προβλέπεται η εξειδίκευση των αρμοδιοτήτων και η ρύθμιση του τρόπου οργάνωσης, λειτουργίας και στελέχωσης του Αυτοτελούς Τμήματος Κλινικών Μελετών στα νοσοκομεία του Ε.Σ.Υ. με εξειδικευμένο και έμπειρο προσωπικό, καθώς και η ρύθμιση κάθε άλλου αναγκαίου ζητήματος.
Το Αυτοτελές Τμήμα Κλινικών Μελετών θα στελεχώνεται με εξειδικευμένο και έμπειρο προσωπικό, και συγκεκριμένα από υπαλλήλους των κλάδων ΠΕ Διοικητικού Οικονομικού ή ΤΕ Διοικητικού Λογιστικού και σε περίπτωση έλλειψης από υπαλλήλους του κλάδου ΔΕ Διοικητικού Λογιστικού, κατ’ ελάχιστο από 2 υπαλλήλους και ο αριθμός τους δύναται να προσαρμόζεται σε κάθε νοσηλευτικό ίδρυμα. Η επιλογή των προσώπων και η τοποθέτησή τους γίνεται από τη διοίκηση του.
Μετάβαση μέχρι τέλη του 2025
Η Ευρώπη προσπαθεί να ανακτήσει τη χαμένη ανταγωνιστικότητά της στην προσέλκυση παγκόσμιων επενδύσεων Έρευνας και Ανάπτυξης. Γι’ αυτό θέσπισε το νέο Ευρωπαϊκό Κανονισμό 536/2014 (CTR) και ένα ενιαίο Πληροφοριακό Σύστημα Κλινικών Δοκιμών (CTIS). Το CTR τέθηκε σε ισχύ στις 31 Ιανουαρίου 2022 όμως, υπάρχει μια 3ετής μεταβατική περίοδος για τις κλινικές δοκιμές που έχουν εγκριθεί βάσει της προηγούμενης νομοθεσίας για τη μετάβαση στον κανονισμό. Μετά τις 31 Ιανουαρίου 2025 όλες οι κλινικές δοκιμές, νέες και τρέχουσες θα διεξάγονται με βάση τον Κανονισμό.
Η ανάπτυξη της Κλινικής Έρευνας στη χώρα μας χρειάζεται ένα βιώσιμο και λειτουργικό οικοσύστημα
«Η υλοποίηση μιας κλινικής μελέτης είναι μια πολύπλοκη διαδικασία και προϋποθέτει τη συμμετοχή πολλών μερών που το κάθε ένα από αυτά να έχει κατανοήσει τον ρόλο του σε στη διαδικασία και όλα μαζί να έχουν συμφωνήσει σε έναν κοινά αποδεκτό στόχο» μας εξηγεί ο Medical Director ΦΑΡΜΑΣΕΡΒ-ΛΙΛΛΥ Γιάννης Χονδρέλης. Όπως λέει η ανάγκη ύπαρξης ενός οικοσυστήματος για την κλινική έρευνα, όπου τα μέρη που το απαρτίζουν έχουν διακριτούς ρόλους, συνεργάζονται αρμονικά μεταξύ τους και φροντίζουν για την ομαλή λειτουργία και βιωσιμότητα του συστήματος είναι παραπάνω από απαραίτητη.
Ποια είναι όμως αυτά τα μέρη του οικοσυστήματος της κλινικής έρευνας, οι ρόλοι, οι ενέργειες που έχουν γίνει ή χρειάζεται να γίνουν;
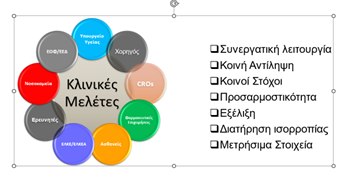
Σχήμα: Το οικοσύστημα της κλινικής έρευνας στη χώρα μας και τα στοιχεία που πρέπει να το χαρακτηρίζουν
Ο Χορηγός μιας κλινικής μελέτης έχει και τη συνολική ευθύνη για τον σχεδιασμό και τη σωστή διεξαγωγή της. Είναι υπεύθυνος για την τήρηση των απαραίτητων διαδικασιών βάσει της Ευρωπαϊκής και Τοπικής νομοθεσίας, αλλά και των Κανόνων της Ορθής Κλινικής Πρακτικής (ICH-GCP Guidelines). Ο Χορηγός, για παράδειγμα μια Φαρμακευτική, αποφασίζει για τις χώρες, στις οποίες θα ανατεθεί η υλοποίηση μιας κλινικής μελέτης. Η απόφαση αυτή στηρίζεται σε μια σειρά κριτηρίων με τα σημαντικότερα να είναι η ταχύτητα των διαδικασιών, η ύπαρξη ερευνητικών κέντρων με υψηλά ποσοτικά και ποιοτικά standards και γενικότερα η ύπαρξη ενός ευνοϊκού/φιλικού περιβάλλοντος για την κλινική έρευνα. Αξίζει να αναφερθεί ότι οι φαρμακευτικές επιχειρήσεις στη χώρα μας διαχρονική καταβάλουν προσπάθεια για την προσέλκυση περισσότερων κλινικών μελετών στην Ελλάδα. Σε αυτή την προσπάθεια για την επίτευξη αυτού του κοινού στόχου, η Πολιτεία χρειάζεται να είναι πολύτιμος αρωγός. Η θεσμοθέτηση κατάλληλων για την κλινική έρευνα οικονομικών κινήτρων, που σήμερα δεν υπάρχουν, θα συνεισέφερε σημαντικά.
Οι κατ’ ανάθεση Οργανισμοί Κλινικής Έρευνας (CROs) είναι οι οργανισμοί/εταιρείες, στις οποίες οι Χορηγοί αναθέτουν, σε πολλές περιπτώσεις, την υλοποίηση επί μέρους διαδικασιών, ή το σύνολο μιας κλινικής μελέτης. Είναι στελεχωμένοι με εξαιρετικά καταρτισμένο προσωπικό, ώστε να φέρουν εις πέρας την υλοποίηση μιας κλινικής μελέτης με επιτυχία τόσο ποσοτικά, όσο και ποιοτικά.
Το Νοσοκομείο αποτελεί ένα σημαντικό μέρος του οικοσυστήματος ως το «βασικό κύτταρο» για τη διεξαγωγή μια κλινικής μελέτης. Το Νοσοκομείο παρέχει τις εγκαταστάσεις και την υποδομή, ώστε τα ερευνητικά κέντρα να μπορούν να διεξάγουν μια κλινική μελέτη. Η κατανόηση από τις Διοικήσεις των νοσηλευτικών ιδρυμάτων της αξίας της κλινικής έρευνας και του πολλαπλού οφέλους για τους ασθενείς, τους ερευνητές, το Ε.Σ.Υ., αλλά και το ίδιο το Νοσοκομείο αποτελεί βασική προϋπόθεση για να υπάρξει το απαραίτητο ενδιαφέρον για την απλούστευση και επιτάχυνση των διαδικασιών. Η ίδρυση αυτοτελών τμημάτων κλινικών μελετών (Γραφεία Κλινικών Μελετών) στα Νοσοκομεία, βάσει του ν.5041 άρθρο 87/ΦΕΚ Α΄87/08.04.2023 και της πρόσφατης Κοινής Υπουργικής Απόφασης (Γ2α/οικ.52875, ΦΕΚ Β’ 5651/10.10.2024), θα συνεισφέρει ουσιαστικά στον συντονισμό και την ταχύτερη διαχείριση των θεμάτων των κλινικών μελετών. Οι αποφάσεις των Διοικήσεων για την ίδρυση αυτών των τμημάτων στα Νοσοκομεία που πληρούν τις προϋποθέσεις είναι το επόμενο βήμα, το οποίο και είναι επιτακτικό να γίνει το συντομότερο δυνατό.
Οι ερευνητές των κλινικών μελετών είναι αυτοί που ουσιαστικά υλοποιούν τις κλινικές μελέτες αναφορικά με την εύρεση και την ένταξη των κατάλληλων ασθενών, τη συνεχή παρακολούθηση αυτών, όπως προβλέπει το πρωτόκολλο της κάθε μελέτης, την καταγραφή των δεδομένων υγείας τους σε κατάλληλα σχεδιασμένες ηλεκτρονικές βάσεις, κ.ά. Η άρτια εκπαίδευσή τους στους Κανόνες της Ορθής Κλινικής Πρακτικής, καθώς και στα ειδικά θέματα της εκάστοτε κλινικής μελέτης είναι απαραίτητη για την ορθή διεξαγωγή των ερευνητικών προγραμμάτων, πάντοτε με τη στενή και συνεχή συνεργασία με τον αντίστοιχο Χορηγό. Το υψηλό επίπεδο των Ελλήνων ερευνητών καταδεικνύεται από τα πολύ καλά αποτελέσματα των ελέγχων και επιθεωρήσεων από τους Χορηγούς και τις διεθνείς και τοπικές Αρμόδιες Αρχές τα τελευταία χρόνια.
Οι τοπικές Αρμόδιες Αρχές, για την Ελλάδα ο Εθνικός Οργανισμός Φαρμάκων (ΕΟΦ) και η Εθνική Επιτροπή Δεοντολογίας για τις Κλινικές Μελέτες (ΕΕΔ), αποτελούν ένα ακόμη σημαντικό μέρος του Οικοσυστήματος. Έχουν τη γενική εποπτεία και την ευθύνη της δημιουργίας και της εφαρμογής του Κανονιστικού πλαισίου για την διεξαγωγή της κλινικής έρευνας στη χώρα μας. Για να μπορούν οι Αρχές να ανταποκριθούν στις διαρκώς αυξανόμενες απαιτήσεις είναι απαραίτητη η διαχρονικά σταθερή στελέχωσή τους με επαρκή αριθμό κατάλληλα εκπαιδευμένων ατόμων. Στο σημείο αυτό τίθεται ένα ζήτημα που απαιτεί άμεση λύση. Είναι επίσης σημαντικό να υπάρξει η δυνατότητα καταγραφής/μέτρησης της δραστηριότητας της κλινικής έρευνας (αριθμός κλινικών μελετών, αριθμός ασθενών, οικονομικός απολογισμός, κλπ.) σε ετήσια βάση και εθνικό επίπεδο, στοιχεία, τα οποία σήμερα δεν είναι διαθέσιμα.
Το υπουργείο Υγείας έχει έναν κομβικό ρόλο στη δημιουργία και διατήρηση του οικοσυστήματος της κλινικής έρευνας. Είναι αυτό που θα αναγνωρίσει τα μέρη του συστήματος και θα διασφαλίσει την μεταξύ τους επικοινωνία/συνεργασία με θεσμικό τρόπο. Η σύσταση της Ομάδας Εργασίας του Υπ. Υγείας για την Ανάπτυξη των Κλινικών Μελετών και της Βιοιατρικής Έρευνας στη Χώρα μας αποτελεί ουσιαστικά την “ιδρυτική πράξη” του οικοσυστήματος και το μέσο για την επικοινωνία των μερών που το απαρτίζουν. Χρειάζεται ωστόσο τακτικότερες συνεδριάσεις (ανά δίμηνο αντί εξάμηνο που ισχύει σήμερα), καθώς και μεγαλύτερη ταχύτητα στην υλοποίηση των αποφάσεων. Με τον τρόπο αυτό, θα αναγνωρίζονται πιο έγκαιρα τα θέματα/προβλήματα και θα επιλύονται άμεσα. Το Υπουργείο Υγείας οφείλει να παρακολουθεί και να ελέγχει την εύρυθμη λειτουργία των μερών του οικοσυστήματος και να παρεμβαίνει είτε διοικητικά είτε νομοθετικά, στις περιπτώσεις που αυτό απαιτείται. Η δημιουργία θέσης/ρόλου στο Υπουργείο Υγείας με αποκλειστική ευθύνη τη βιοιατρική έρευνα θα βοηθούσε σημαντικά στη συλλογή και επίλυση, αλλά και στην παρακολούθηση και τον έλεγχο των ποικίλων ζητημάτων που προκύπτουν καθημερινά. Η ανταγωνιστικότητα της χώρας μας στο πεδίο των κλινικών μελετών σχετίζεται σε μεγάλο βαθμό με τον ενεργό ρόλο του Υπουργείου Υγείας, όπως περιγράφεται παραπάνω.
Οι ασθενείς, είτε ως άτομα, είτε ως οργανωμένες ομάδες, είναι από τα πλέον σημαντικά μέρη του οικοσυστήματος, δεδομένου ότι αποτελούν τους βασικούς παράγοντες για την πραγματοποίηση μιας κλινικής μελέτης. Σήμερα, ο ρόλος των ασθενών είναι πολυδιάστατος και εκτείνεται, πέραν της συμμετοχής στα ερευνητικά προγράμματα, στον σχεδιασμό των μελετών, στην εκπαίδευση και στη γνωμοδότηση αναφορικά με τη διεξαγωγή κλινικών μελετών. Η συμμετοχή τους σε κλινικές μελέτες διευκολύνεται από τη δυνατότητα ενημέρωσης για τα ερευνητικά προγράμματα που είναι σε εξέλιξη στη χώρα μας. Η δυνατότητα αυτή δεν υπάρχει σήμερα επίσημα και οργανωμένα από την πολιτεία. Στην εποχή της ψηφιακής τεχνολογίας, η πρόσβαση στην πληροφορία αποτελεί αναπόσπαστο τμήμα στην καθημερινότητα όλων μας, πολύ δε περισσότερο για τους ίδιους τους ασθενείς, για τους οποίους η πληροφορία για θέματα υγείας είναι αναφαίρετο δικαίωμα.
Οι Φορείς Οικονομικής Διαχείρισης (ΕΛΚΕ/ΕΛΚΕΑ) ως μέρη του οικοσυστήματος διασφαλίζουν τη διαφάνεια και την ορθότητα στην οικονομική διαχείριση των κλινικών ερευνητικών προγραμμάτων. Για την αποφυγή της γραφειοκρατίας και των αδικαιολόγητων καθυστερήσεων, όπως για παράδειγμα στην υπογραφή των συμβάσεων, είναι απαραίτητο να υπάρξουν ενιαίες Πρότυπες Διαδικασίες (SOPs) με εφαρμογή σε όλους τους Φορείς και σε όλη την Επικράτεια.
Κλείνοντας ο κ. Χονδρέλης επισημαίνει ότι πρόσφατη έκθεση της IQVIA για λογαριασμό της Ευρωπαϊκής Ομοσπονδίας Φαρμακευτικών Επιχειρήσεων και Συνδέσμων (EFPIA) και της Vaccines Europe, έδειξε ότι το μερίδιο της Ευρώπης στις κλινικές μελέτες που χρηματοδοτούνται από φαρμακευτικές εταιρείες έχει υποχωρήσει από 22% το 2013 σε μόλις 12% το 2023. Αρκετοί είναι οι λόγοι για τη μείωση αυτή, με κυριότερο τις μικρές ταχύτητες στην έναρξη των κλινικών μελετών. Επειδή η Ευρώπη, ως γεωγραφική περιοχή, δεν μπορεί να λείπει, η επιτάχυνση στις διαδικασίες θα αποτελέσει το κρίσιμο κριτήριο για την επιλογή μιας ευρωπαϊκής χώρας. Αυτό καθιστά ακόμα πιο επιτακτική την ανάγκη για ένα λειτουργικό και βιώσιμο οικοσύστημα για την κλινική έρευνα στη χώρα μας. Η ευκαιρία υπάρχει όπως λέει και η Ελλάδα έχει τη δυνατότητα να διεκδικήσει δυναμικά τη συμμετοχή της στην κλινική έρευνα σε παγκόσμια κλίμακα.